近日李汉璋/赵永娟课题组在iScience上在线发表题为“A cell-permeant mimetic of NMN activates SARM1 to produce cyclic ADP-ribose and induce non-apoptotic cell death”的研究论文。该研究在分子层面上系统证明了参与神经元轴突变性调控的关键分子SARM1是一个自抑制、可被NAD+代谢前体NMN激活的NADase和cADPR合成酶,为深入探究SARM1在神经系统疾病中的作用机理以及药物开发提供了重要依据和工具。
该研究组组长早年发现了一个新的Ca2+信使分子——环腺苷核糖(cADPR),调节诸如肌细胞收缩、胰岛素分泌、T淋巴细胞激活和神经细胞增殖分化等生理反应。CD38是研究最多的cADPR合成酶,不过在CD38敲除小鼠脑组织中依然存在较高水平cADPR,提示有其他合成酶的存在。
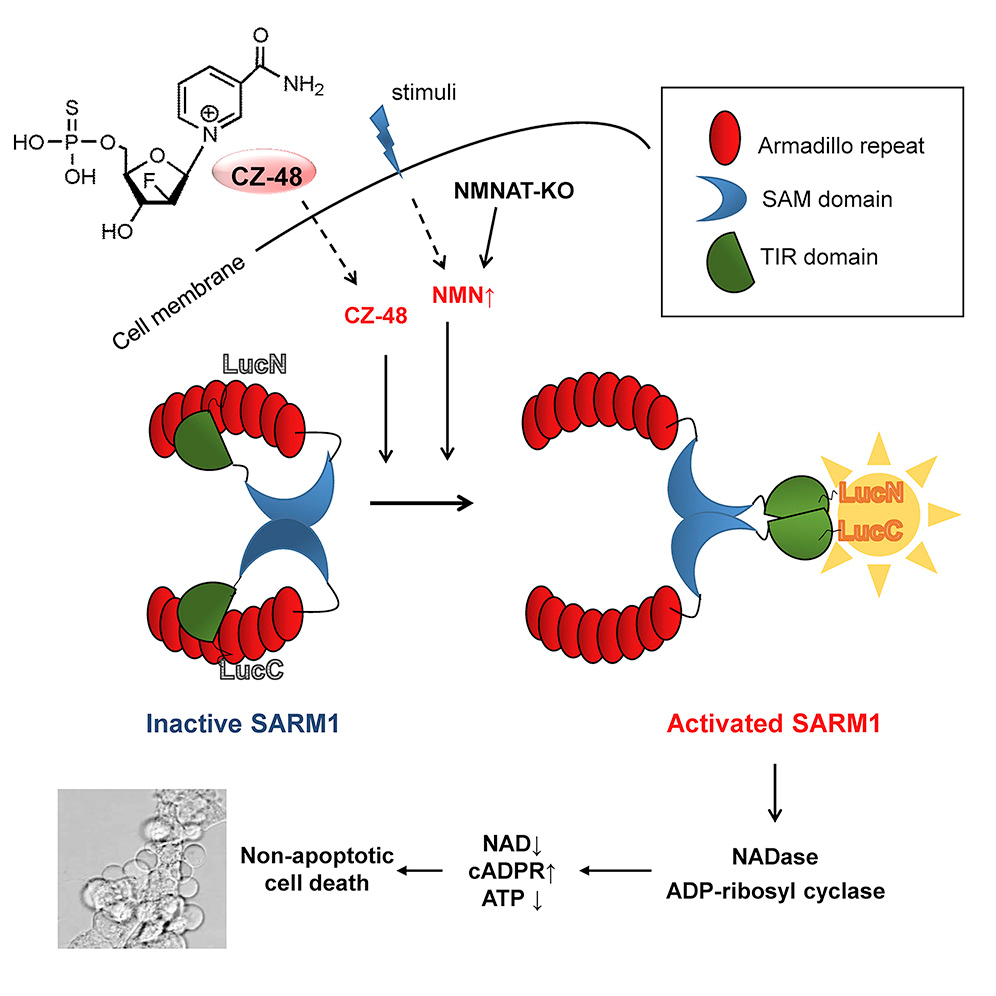
SARM1是Toll样受体家族的接头蛋白,在周围神经病变、创伤性脑损伤、神经退行性疾病等多种神经系统疾病中发挥关键作用。研究表明,损伤可以激活SARM1并引发轴突变性,其机制扑朔迷离。直到2017年,Essuman等报道了SARM1的TIR结构域具有NADase活性,使得人们开始理解它的作用机制。
该研究组在研究CD38的过程中,意外发现其抑制剂CZ-48反而可以诱导cADPR的产生,基因敲除实验证明CZ-48通过SARM1起作用。实验证明,CZ-48是一个可透膜、抗降解的NMN类似物,它激活SARM1是模拟内源NMN的作用。而激活后SARM1和CD38非常类似,具有多种活性,包括水解和环化NAD+、水解cADPR以及NADP碱基交换等。实验证明,SARM1在细胞内处于非活化状态,NMN/CZ-48使其发生构象变化,包括释放自抑制结构域和酶促结构域的二聚化等,从而使其具有酶促活性,诱导线粒体功能障碍并引起非凋亡性细胞死亡。
该工作的意义在于,确定了SARM1是一个新的可诱导cADPR信号酶,是该信号通路的里程碑式发现;揭示了NAD+代谢途径中的一条负反馈途径——NAD+的合成前体激活NAD+的消耗酶SARM1,为NAD+代谢研究、以及前体(包括NMN、NR和烟酰胺等)用药提供了新观点;进一步证实了SARM1介导的损伤等引起的神经退行性疾病的分子机制,为靶向药物开发提供了重要依据和有效工具。
以上研究由李汉璋教授和赵永娟副教授共同指导,由博士研究生赵志英以及课题组成员合作完成。以上工作得到了北大药学院张礼和院士和张亮仁教授、以及本学院许正双副教授等在小分子合成中给予的大力帮助,并得到了国家自然科学基金的资助。
论文链接:https://www.cell.com/iscience/fulltext/S2589-0042(19)30137-3