三尖杉二萜是一类分子结构丰富多样的天然产物,其中多个分子具有重要的生理活性,例如,海南粗榧内酯 harringtonolide (5) 具有优异的抗 KB 肿瘤活性(IC50 = 43 nm)。关于该分子,翟宏斌课题组数年前完成了其首次不对称全合成(Angew. Chem. Int. Ed. 2016, 55, 11638)。Mannolides A−C 是中国科学院上海药物研究所岳建民院士课题组从生长在西双版纳的粗榧类植物枝干和叶子中首次分离、发现的 cephalotane-type C20 三尖杉二萜天然产物,被认为是 harringtonolide 型降二萜和 cephanolide 型降二萜的生源前体。Mannolide C 具有复杂六环结构,具体包括一个高张力全碳 [7/6/6/5] 四环骨架、一个六元内酯和一个五元内酯;结构中共含有 9 个手性中心,其中 8 个为连续的手性中心, 2 个为全碳季碳手性中心(图1)。
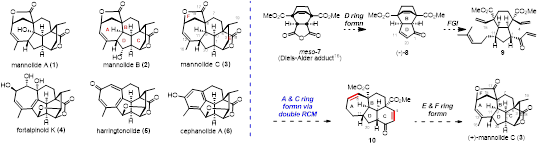
图 1. 代表性三尖杉二萜天然产物分子及 Mannolide C 的合成策略分析
近日,北京大学深圳研究生院翟宏斌课题组实现了三尖杉二萜天然产物 (+)-mannolide C 的首次不对称全合成。合成工作中运用双 RCM 反应实现了核心四环骨架的高效构筑,其它关键步包括酶催化动力学拆分、镍催化立体选择性 Michael 加成和三价锰催化的烯丙位氧化等(图 1)。
首先以易得的 meso-酸酐 7 为原料,通过亲核加成和原位脱水反应得到rac-烯醇内酯 11。化合物 11 依次经过内酯半还原、原位分子内 aldol 缩合反应、羟基甲磺酰化和消除反应生成 rac-烯酮 8。随后经过还原、Lipozyme TL IM酶催化的动力学拆分和氧化反应产生构型正确的烯酮 (-)-8,后者经过 Michael 加成、Wittig 反应和水解得到醛 14。化合物 14再进行一锅法缩醛和环氧保护、双键臭氧化、Wittig 烯化、Zn 介导的环氧还原和缩醛脱保护、乙烯基格氏试剂亲核加成和氧化生成双 RCM 反应的前体化合物 9(图 2)。
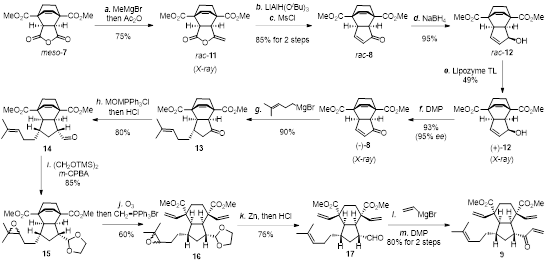
图 2. 四烯化合物 9 的合成路线
作者筛选、优化了双 RCM 这一关键转化的反应条件,得到了预期的核心四环中间体 10(图 3)。调整 C1 位的立体构型后通过镍催化的 Michael 加成反应立体选择性地产生化合物 20。还原羰基和原位发生内酯化反应生成五环产物 21。锰催化的烯丙位氧化和羰基α位甲基化反应得到烯酮 23。还原烯酮 23 产生化合物 24。最后,进行双键双羟化、原位酸性条件关五元内酯和Burgess试剂脱水完成了 (+)-mannolide C 的不对称全合成合作(图 4)。
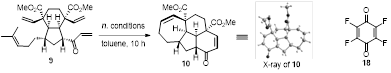
entry |
conditions |
result |
1 |
H-G 2nd catalyst, Ar, 90 °C |
no desired product |
2 |
H-G 2nd catalyst, ethylene, 90 °C |
no desired product |
3[a] |
H-G 2nd catalyst, 18, 90 °C |
10 (trace) |
4 |
H-G 2nd catalyst, 18, 110 °C |
10 (45%) |
5 |
H-G 2nd catalyst, 18, 130 °C |
10 (25%) |
6 |
H-G 2nd catalyst, 18, microwave, 110 °C |
10 (30%) |
7 |
H-G 2nd catalyst, microwave, 110 °C |
10 (50%) |
8[b] |
H-G 2nd catalyst, microwave, 150 °C, 30 min |
10 (70%) |
9 |
H-G 2nd catalyst, microwave, 200 °C |
decomposition |
[a] Additive 18 = 2,3,5,6-Tetrafluorocyclohexa-2,5-diene-1,4-dione. [b] Reaction time = 30 min.
图 3. Double RCM反应的条件筛选
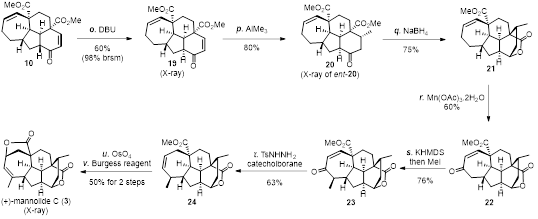
图 4. (+)-Mannolide C的不对称全合成
综上,翟宏斌课题组从 meso-酸酐 7 出发,基于双 RCM 环化策略,实现了 (+)-mannolide C 的首次高效不对称全合成,总线性步骤为22步。该合成策略有望应用于 cephalotane-type C20 三尖杉二萜家族其它分子的全合成中。相关工作最近发表于 Angew. Chem. Int. Ed.。
以上工作主要由翟宏斌课题组的博士研究生敖巧巧和张海军博士(共同第一作者)依托北京大学深圳研究生院省部共建肿瘤化学基因组学国家重点实验室完成。