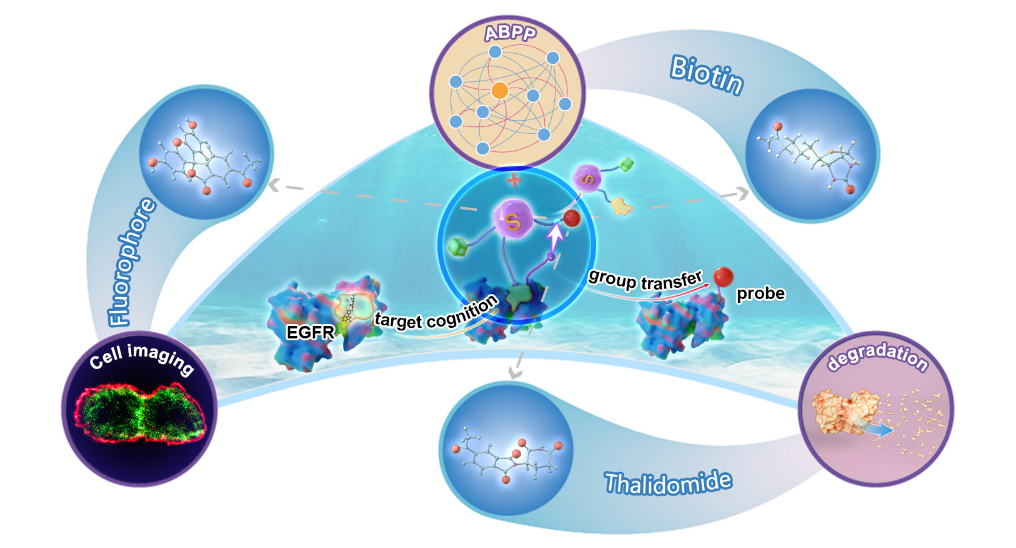
近日,北京大学深圳研究生院李子刚/尹丰课题组在中国化学会旗舰期刊《CCS Chemistry》发表了题为“A proximity-triggered strategy towards transferable PROTACs”的研究论文。该论文通过配体导向化学,开发了一种基于锍盐分子的“基团转移”策略用于靶标蛋白半胱氨酸(Cysteine,Cys)的位点选择性修饰。“基团转移”策略成功地用于PROTAC领域显示出该策略的实用性,当作者将“转移基团”稍加改造,该策略即可被用于更多化学生物学的研究,诸如PTM研究,活细胞成像以及蛋白质组学研究等等。
图一、基于硫盐中心的“基团转移”策略用于“可转移PROTAC”示意图
EGFR是NSCLC诊断和治疗研究的最重要药物靶点之一。EGFR-TKIs虽然对治疗NSCLC有显著疗效,但其维持时间短,绝大多数EGFR TKIs治疗有效的患者最终都会复发耐药,成为了当前临床肺癌治疗面对的巨大挑战。PROTAC是药物研发领域的一个新兴方向,其目的不是抑制靶标而是诱导靶标蛋白通过UPS(泛素-蛋白酶体系统)被降解,为解决小分子抑制剂的耐药性问题带来了希望。PROTACs由三部分组成,通过中间的连接基团将一个靶标蛋白的配体和一个特异性招募E3连接酶的配体连到一起。因此,PROTACs可以同时结合目标蛋白和E3连接酶,进而形成目标蛋白-PROTACs-E3连接酶三元复合物。PROTACs劫持E3连接酶,将目标蛋白多聚泛素化,通过UPS选择性降解目标蛋白。然而传统PROTACs分子的设计合成比较繁琐,为其后续的生物研究以及临床应用带来困难。
李子刚/尹丰课题组前期发展了一种侧链硫盐稳定多肽对蛋白质定点修饰策略。由此出发,作者设想能否将锍盐中心引入到PROTACs分子的设计当中,发展一种简单易得,适用于任何“蛋白质-抑制剂”系统的锍盐工具用于快速判断特定靶标的降解效率。于是作者在Osimertinib配体上引入锍盐中心,希望在Osimertinib导向下,通过邻近靶标Cys对硫盐中心的亲核进攻,发生基团转移反应,将锍盐中心上的功能基团Thalidomide转移到靶标蛋白上,形成“靶标-Thalidomide”偶联物,实现UPS诱导的EGFR降解。
首先,作者对锍盐的合成进行了简单摸索,Osimertinib和硫醇通过迈克尔加成生成硫醚,接着在弱酸性下与苄基溴取代生成锍盐分子。化学上,作者通过原位NMR确定了高浓度的苄基二甲基锍盐(10 mM)和Ac-Cys-OH(50 mM)之间的反应性。Ac-Cys-OH上亲核性巯基能进攻苄基二甲基锍盐上的苄基,发生“基团转移”反应,得到苄基化Ac-Cys-OH产物。于是,作者合成了一系列带有苄基接头的锍盐,探索其和重组EGFR的反应。胶内荧光实验和DFT计算都验证了带有苄基的叠氮基团转移到重组EGFR上。除了简单的正交基团,带有苄基接头的Cy5荧光基团也能被转移到重组EGFR上。为了探究基团转移反应的化学特性,作者合成了带有其他接头的生物素硫盐,通过WB验证苄基接头表现出较好的转移效率。竞争实验说明导向配体对靶标的识别对“基团转移”反应的发生与否至关重要。不同激酶的WB结果验证了反应的靶标选择性。最后,LC-MS/MS确定了1-IX可以位点选择性标记重组EGFR的Cys775。
为了探究该基团转移策略能否适用于PROTAC领域,作者合成了带有CRBN配体的锍盐降解子1-X。通过WB发现1-X对EGFR的降解效果随着药量和时间的增加而加强。由于1-X跟EGFR结合后才会触发基团转移反应,而通常认为EGFR的降解在结合阶段就能发生,为了进一步探究降解发生的原因,作者合成了几个对照分子。没有EGFR结合配体的5以及没有CRBN结合配体的8无法降低EGFR表达水平,更重要的是,拥有双配体的硫醚分子6、1-X水解产物7和9未能降解EGFR证实了EGFR的降解是通过转移Thalidomide基团引起的。
为了验证降解是由CRBN介导的,作者用带有甲基化修饰的Thalidomide(1-XIII)和带有苄基化修饰的Thalidomide(1-XIV)作为阴性对照处理A549细胞。阴性对照未能降解EGFR,这证实了EGFR的降解是由CRBN介导的。为了探究1-X诱导EGFR降解是否通过泛素-蛋白酶体途径,作者用MLN-4924抑制剂或Thalidomide竞争剂预处理细胞后EGFR没有降解,说明降解是由E1和E3介导的。作者将带有HA标签的泛素表达质粒瞬时转染到A549细胞中,并加药处理细胞,免疫沉淀(IP-WB)检测泛素化EGFR蛋白。1-X处理样品的泛素化EGFR水平高于没有1-X处理的样品,说明1-X介导的EGFR降解伴随着EGFR的泛素化。进一步得,作者发现加入蛋白酶体抑制剂MG-132可以减缓1-X诱导的EGFR的降解,说明该降解是通过蛋白酶体途径发生的。综上表明1-X诱导的EGFR降解是通过“泛素-蛋白酶体”途径发生的。最后,作者通过RT-PCR表明1-X诱导的EGFR降解是发生在蛋白质水平的。
为了探究硫盐分子的生物学功能。作者通过HTRF确定1-IX可以抑制EGFR磷酸化。由于EGFR磷酸化被抑制会阻断EGFR信号传导通路,从而会抑制肿瘤细胞的生长。于是作者通过MTT验证了1-IX/1-X对肺癌细胞的生长有抑制作用。1-X抑制肺癌细胞生长可能是由于1-X诱导的EGFR降解导致的。细胞周期和细胞凋亡实验说明了1-IX/1-X诱导了肺癌细胞的G0/G1周期停滞和中后期凋亡。为了扩展基团转移策略的普适性,作者合成了带有Adamantane功能基团的锍盐分子1-XV。通过另一种蛋白降解策略(HyT)使用疏水标签来模拟部分变性的蛋白质折叠状态,从而诱导分子伴侣介导蛋白酶体降解。1-XV对EGFR的降解效果随着时间和药量的增加而加强。
总之,通过配体导向的邻近效应,作者开发了一种基于锍盐中心的“基团转移”策略对蛋白质Cys进行位点选择性修饰,该策略成功应用于PROTACs领域实现了UPS途径的EGFR靶向降解。该可转移PROTACs和其他共价PROTACs都没法实现催化再循环,这导致了至少化学计量的浓度才能诱导靶标蛋白质降解。然而,受益于共价连接的可转移PROTAC策略能增加降解的靶标亲和力以及动力学优势。可转移的PROTAC策略仅需要通过简单的配体组装,用于快速判断特定靶标的降解效率。作者相信,出于不同的目的,不同的功能基团可以选择性标记到靶标上,用于模拟PTM修饰、活细胞成像以及化学蛋白质组学研究等。
北大深研院的王跃娜博士,万川博士和赵融通博士完成了实验的主要部分,深圳湾实验室的康微博士,王蕊博士,深圳大学的江承尧博士对本论文做出了重要贡献。论文得到了国家自然科学基金,国家博士后基金,国家重点研发计划“合成生物学”重点专项,广东省自然科学基金,深圳市科技创新委员会的支持。
论文链接https://doi.org/10.31635/ccschem.022.202201985