随着生物学研究的不断深入,科学家们对于理解生物体内蛋白质的功能和相互作用方式的需求日益迫切。蛋白质作为生命活动的主要执行者,在调控细胞代谢、信号传导、细胞结构构建等方面发挥着至关重要的作用。而活细胞中的蛋白质组学研究,则是一项关键的领域,其重要性在于能够真实地反映细胞内蛋白质的动态变化和功能状态。传统的蛋白质组学研究大多采用离体蛋白质提取和分析的方法,虽然在一定程度上能够揭示蛋白质组的组成和结构特征,但却无法完全还原蛋白质在活细胞中的真实情况。因此,活细胞中的化学蛋白质组学方法应运而生,通过在活细胞内直接对蛋白质进行修饰、标记和分析,能够更准确地揭示蛋白质的功能、调控机制以及相互作用网络。活细胞中化学蛋白质组学方法的研究不仅在理论上具有重要意义,更在实践中展现了广阔的应用前景。通过这些方法,科学家们能够实时监测细胞内蛋白质的变化,解析蛋白质在细胞信号传导、代谢调控等生命过程中的作用机制,为相关疾病的治疗和药物研发提供重要依据。因此,活细胞中的化学蛋白质组学研究正成为当前生命科学领域的热点之一,引起了广泛的关注和持续的探索。
近日,北京大学深圳研究生院/深圳湾实验室坪山生物医药研发转化中心的李子刚/尹丰课题组,在国际知名期刊Chemical Science等上发表了一系列论文,报道了一系列化学蛋白质组学方法,通过一系列基于正电性化学的蛋白质标记方法的开发,拓宽了活细胞中赖氨酸和半胱氨酸特异性蛋白质组标记的工具箱。
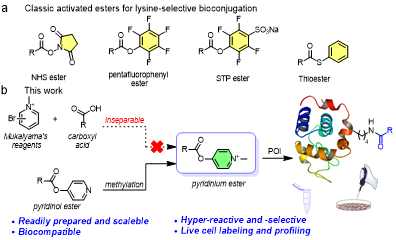
赖氨酸是绝大部分蛋白质表面可溶剂化氨基酸残基中丰度较高的残基,常位于重要的活性口袋或药物靶点位置附近。然而,在生理环境中(pH 7.4),赖氨酸的氨基侧链通常处于质子化状态,其亲核反应性大大降低,因此,活细胞中赖氨酸的选择性标记和修饰一直是蛋白质化学研究中的难点。因此,活细胞中赖氨酸的选择性标记和修饰,一直是蛋白质化学研究中的重点和难点。而能实现活细胞中赖氨酸残基的高效和高选择性化学标记,无论是在化学生物学基础研究还是生物医药研究中都具有重要意义。
李子刚/尹丰课题组通过合成步骤的改进,成功合成了一类稳定的吡啶盐活性酯化合物。通过一系列模式多肽和蛋白的酰胺化标记反应研究,确定了一类高效的赖氨酸选择性的蛋白质标记策略,并在活细胞中对赖氨酸残基进行选择性修饰,在MCF-7活细胞中进行了ABPP分析。研究结果显示,该方法具有低毒性、高效性和赖氨酸选择性,并成功标记了细胞中约70%的赖氨酸选择性蛋白组,其中43个蛋白定位于线粒体。这项研究为分析内源蛋白质提供了重要的化学策略,为活细胞中蛋白质修饰和时空定位研究提供了新的手段。
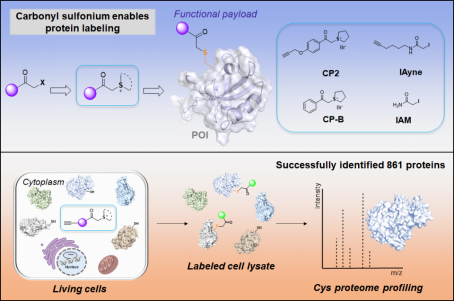
另外,针对活细胞中蛋白质中的半胱氨酸的化学选择性修饰,李子刚/尹丰课题组提出了一种基于β-羰基锍盐化合物的新颖策略。通过对锍盐结构的调节,他们设计出具有高反应性和选择性的锍盐探针,该探针在活细胞中显示出优异的生物相容性、细胞穿膜性和对半胱氨酸的选择性。
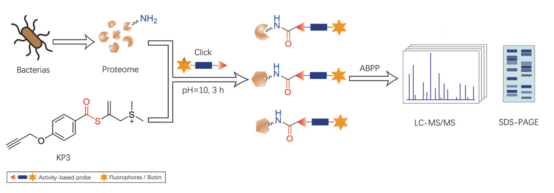
最后一项研究则针对碱性条件下的赖氨酸选择性蛋白质修饰进行了探索。李子刚/尹丰课题组构建了一系列基于炔丙基锍盐的活性酯化合物,利用其强亲电性在碱性条件下与赖氨酸残基的氨基反应,通过形成酰胺键实现了对赖氨酸的选择性修饰。经过蛋白层面上的一系列优化后,该策略能成功应用于多种细菌赖氨酸残基的蛋白质标记,并结合活性蛋白组学技术成功鉴定和分析了数百个细菌蛋白质中的被标记赖氨酸残基。
北大深研院研究生胡昶星、深圳技术大学万川副研究员和仲恺农业工程学院杨冬燕博士等共同发表了以上论文,北大深研院李子刚教授和卢菲教授、深圳湾实验室坪山生物医药研发转化中心王蕊博士和尹丰研究员等为以上论文的通讯作者。坪山转化中心安禹豪等对本工作亦有贡献。以上工作得到了国家科技部、国家自然科学基金、广东省自然科学基金、深圳市科技创新委员会的支持。
全文链接:
Chem. Sci. 2024: 10.1039/d3sc05766f
Chem. Commun. 2024: 10.1039/D4CC00295D
Synlett 2024: 10.1055/s-0042-1751571