神经系统的正常生理过程依赖于脑内快速的信息交流,神经元之间的信息沟通是通过突触连接来实现。突触发育和功能的异常通常导致各种神经发育类疾病,包括孤独症(又称自闭症)。神经连接蛋白Neuroligins(Nlgns)是高度保守的细胞粘附分子蛋白家族,定位于突触后膜的Nlgn分子通过与突触前Neurexin相互作用调节突触可塑性。在人类基因组中有5种Nlgn亚型(Nlgn1-4,-4Y),其中Nlgn3和Nlgn4基因突变直接导致孤独症。利用Nlgns转基因小鼠的研究表明神经元中的Nlgns对突触成熟及功能维持有重要调控作用。譬如,在小脑浦肯野环路中敲除Nlgn3和/或Nlgn1降低爬行纤维突触传递功能,敲除Nlgn2选择性降低抑制性突触传递功能,Nlgn2和Nlgn3双敲除小鼠会进一步抑制突触传递功能(张勃等,2015)。在小脑星状中间神经元中同时敲除Nlgn1,Nlgn2和Nlgn3抑制NMDA受体介导的兴奋性突触传递 (张勃等,2016)。在亚突触水平上,张勃课题组工作表明Nlgn3通过聚集突触后AMPA受体与PSD95复合物,调控AMPA受体介导的突触传递 (韩颖等, 2022)。然而,单细胞测序数据显示Nlgn在神经元和非神经元细胞(包括星形胶质细胞)中都有表达,暗示星形胶质细胞中的Nlgns可能参与对突触可塑性的调控。大量研究证实星形胶质细胞在神经精神疾病中扮演重要作用,但目前针对星形胶质细胞如何调控突触连接功能仍然存在很大争议,且其调控机制尚不明确。
小脑在运动学习和平衡协调方面发挥重要作用,很多研究结果显示小脑对语言、情感调控、及神经精神疾病发生发展等也起重要作用。小脑中存在多种星形胶质细胞(包含伯格曼胶质细胞)。伯格曼胶质细胞是典型的星形胶质细胞,具有位于浦肯野细胞层的较大的细胞体和延伸到小脑皮层分子层的复杂终末。伯格曼胶质细胞终末包裹了突触前的爬行纤维或平行纤维和浦肯野细胞树突棘,且伯格曼胶质细胞终末表达谷氨酸受体及谷氨酸转运体,维持突触中谷氨酸的平衡,而过表达或者敲除胶质细胞中的谷氨酸受体或者抑制谷氨酸转运体则改变突触传递效率。这些研究表明,在星形胶质细胞中特定蛋白的具体定位对其在突触可塑性及神经环路中的功能有重大影响。因此,系统性解析神经连接蛋白mRNA是否在星形胶质细胞中翻译、翻译后的Nlgn3蛋白质的定位以及探究其在突触传递和大脑功能中的作用,对深入理解星形胶质细胞特异性Nlgns在神经精神疾病中扮演的角色至关重要。
近期,深圳湾实验室神经疾病研究所、北京大学深圳研究生院化学生物学与生物技术学院张勃课题组在Molecular Psychiatry杂志发表了题为Astrocytic Neuroligin-3 influences gene expression and social behavior, but is dispensable for synapse number的研究论文,提出在中枢神经系统中,孤独症相关的细胞粘附分子Nlgn3在星形胶质细胞中通过影响基因表达进而影响小鼠社交行为。
为了研究星形胶质细胞中Nlgn3的作用,作者利用星形胶质细胞特异的Cre工具鼠 (Aldh1L1-cre/ERT2)特异性敲除星形胶质细胞中的Nlgn3,发现小脑中的Nlgn3蛋白显著降低(约40%),而前脑中的Nlgn3蛋白总量没有改变,说明小脑中的星形胶质细胞大量表达Nlgn3。接下来作者进行了系统全面的结构和功能检测,数据表明敲除星形胶质细胞中的Nlgn3不影响星形胶质细胞的数量和形态,也不影响突触数量和功能(图一)。因此,星形胶质细胞中的Nlgn3并没有在突触数量和功能中发挥作用。

图一:敲除星形胶质细胞中的Nlgn3不影响胶质细胞的形态及突触的数量和功能。
星形胶质细胞终末紧密包裹突触前和突触后结构形成经典的“三元突触”,但是星形胶质细胞中的Nlgn3敲除不影响突触结构和功能,作者分析可能有2个原因:1)Nlgn3定位于星形胶质细胞终末,但不调控突触结构和功能;2)Nlgn3并不定位于星形胶质细胞的终末。为了区分这些可能性,作者采用CRISPR/Cas9技术研究内源性Nlgn3蛋白在细胞中的定位。作者首先通过内源标定神经元中的Nlgn3确定方法的有效性和特异性。进而作者在体外培养和小脑中的星形胶质细胞标定Nlgn3,发现星形胶质细胞中的Nlgn3主要定位于星形胶质细胞的胞体区域而不是终末(图二)。这个解释了为什么敲除星形胶质细胞中的Nlgn3并不影响突触数量和功能。

图二:星形胶质细胞中Nlgn3主要定位于细胞胞体。
位于胞体中的蛋白可能参与多种功能,前人的工作暗示Nlgn3可能调控钙稳态相关的信号。为了探究胞体中的Nlgn3作用,利用空间转录组技术,作者首先鉴定小脑皮层中各个主要的细胞类型中的基因表达。进一步比较分析发现,敲除星形胶质细胞中的Nlgn3改变多种细胞类型中的基因表达,其中细胞内的钙稳态通路相关基因显著变化,证实了星形胶质细胞中Nlgn3可以直接影响钙稳态信号通路。最后,为了探究敲除星形胶质细胞中的Nlgn3对行为的影响,作者发现,敲除星形胶质细胞中的Nlgn3增加小鼠的社交新颖性,而不改变小鼠的运动能力及焦虑水平(图三)。
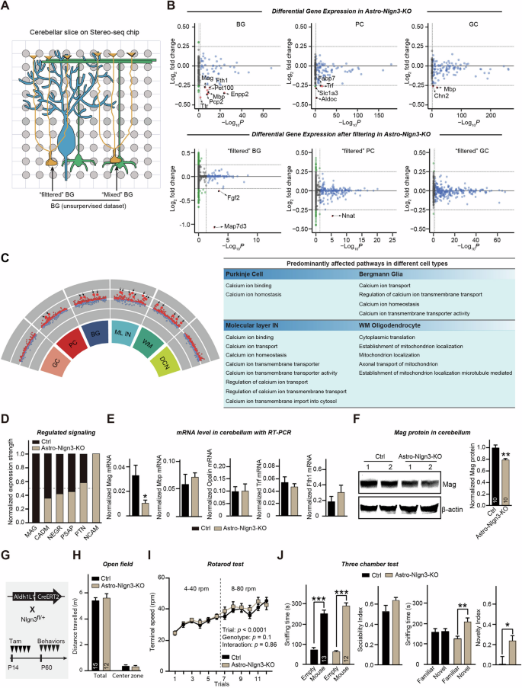
图三:星形胶质细胞中Nlgn3参与调控基因表达和小鼠行为。
因此,通过结合多种研究方法,这个工作首次表明:星形胶质细胞中的Nlgn3主要定位于胞体而不是细胞终末;星形胶质细胞中的Nlgn3调控基因表达和社交行为,但不影响突触的数量和功能(图四)。至此,神经元和非神经元中Nlgn3的利用完全不一样的机制调控神经环路和行为。鉴于Nlgn3突变或缺失和孤独症强相关,本研究对于孤独症的致病原因有着重要的启示作用。
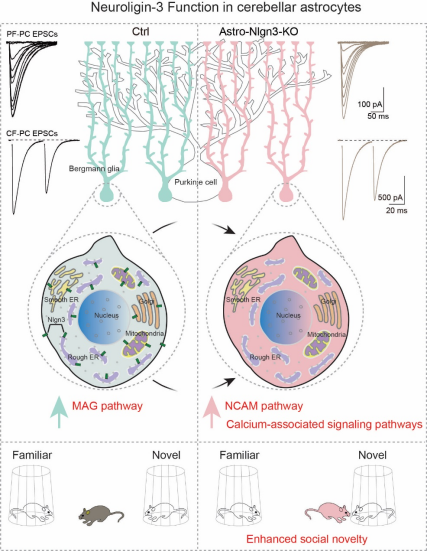
图四:星形胶质细胞中Nlgn3的定位及功能总结图
张勃课题组助理研究员覃丽明博士为论文的第一作者,华大研究院的博士研究生刘知理博士为该论文的共同第一作者,张勃特聘研究员为最后通讯作者(lead contact),北京华大生命科学研究院的副研究员孙宇哲博士和斯坦福大学Thomas Südhof教授为论文的共同通讯作者。。本研究得到国家自然科学基金、深圳湾实验室重大项目、深港脑科学创新研究院等基金项目的资助。
张勃课题组(www.bozhanglab.org)利用神经科学前沿研究手段,深度探究神经突触形成及功能的分子机制,以及突触损伤在神经精神疾病中的作用机制。课题组目前有两个主要的研究方向:1),突触形成和功能维持的分子机理。目前在细胞粘附分子Nlgn的系统研究工作已以最后通讯或唯一通讯身份发表了多篇高水平的研究论文,包括Molecular Psychiatry (2024) 、Science Advances (2022)、Journal of Experimental Medicine (2018) 、Molecular Psychiatry (2017, F1000推荐) 、Journal of Neuroscience (2016,F1000推荐),研究工作受到国自然-国际合作、国自然-优青、国自然-面上等项目支持。课题组还关注孤儿GPCR在突触和神经精神疾病中的作用,这一方向有多个课题展现出非常好的前景。2),神经精神疾病的核心症状的药物干预。这一方向的我们课题组有多点布局,希望早日和神经科学社区分享我们的研究成果。真诚邀请欢迎有志于分子神经生物学的的科研工作者(助理研究员/博士后/博士研究生)加入我们的课题组。